CTI华测检测可以为您提供【体外除颤器】注册检测解决方案,可覆盖的检测服务范围有:医疗器械电气安全、EMC测试、专标测试、小孔径连接件要求、生物相容性测试、软件测试、包装运输及老化实验、清洗消毒灭菌验证等服务。
风险等级分类
根据《医疗器械分类目录》中的呼吸、麻醉和急救器械目录,产品管理类别为II类,产品分类编码为08呼吸、麻醉和急救器械-03急救设备-01体外除颤设备。
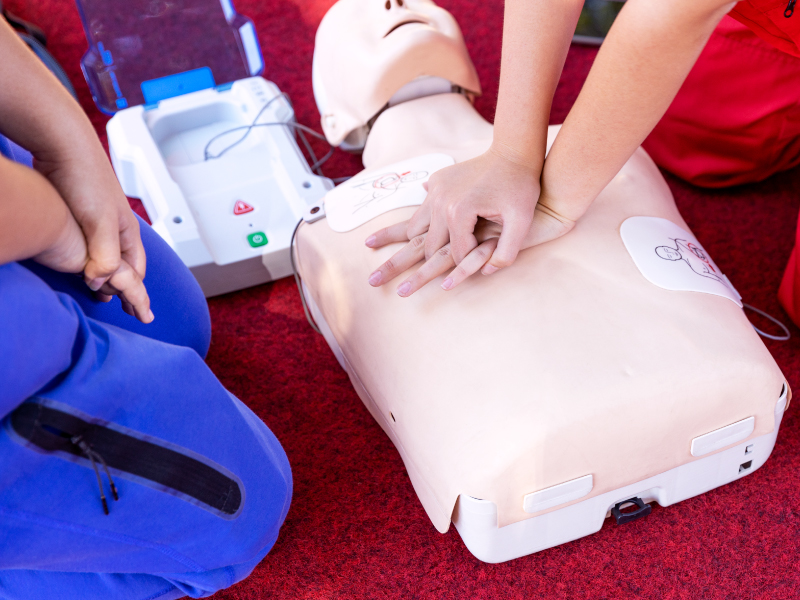
体外除颤器--注册检测
CTI华测检测可以为您提供【体外除颤器】注册检测解决方案,可覆盖的检测服务范围有:医疗器械电气安全、EMC测试、专标测试、小孔径连接件要求、生物相容性测试、软件测试、包装运输及老化实验、清洗消毒灭菌验证等服务。
体外除颤器--测试标准
国内注册-检测方案
|
项目说明 |
标准编号 |
标准名称 |
|
安规 |
GB 9706.1-2020 |
医用电气设备 第1部分:基本安全和基本性能的通用要求 |
|
YY/T 9706.106-2021 |
医用电气设备 第1-6部分:基本安全和基本性能的通用要求 并列标准:可用性 |
|
|
GB/T 14710-2009 |
医用电器环境要求及试验方法 |
|
|
YY 9706.111-2021 |
医用电气设备第 1-11 部分:基本安全和基本性能的通用要求并列标准:在家庭护理环境中使用的医用电气设备和医用电气系统的要求 |
|
|
YY 9706.112-2021 |
医用电气设备 第 1-12 部分:基本安全和基本性能的通用要求 并列标准:预期在紧急医疗服务环境中使用的医用电气设备和医用电气系统的要求 |
|
|
报警 |
YY 9706.108-2021 |
医用电气设备 第1-8部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
|
EMC |
YY 9706.102-2021 |
医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验 |
|
专用标准 |
GB 9706.204-2022 |
医用电气设备 第 2-4 部分:心脏除颤器的基本安全和基本性能专用要求 |
|
YY/T 0196-2005 |
一次性使用心电电极 |
|
|
生物学评价 |
GB/T 16886.1-2011 |
医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5-2017 |
医疗器械生物学评价第5部分:体外细胞毒性试验 |
|
|
GB/T 16886.10-2024 |
医疗器械生物学评价 第10部分:皮肤致敏试验 |
|
|
GB/T 16886.12-2023 |
医疗器械生物学评价 第12部分:样品制备与参照材料 |
|
|
GB/T 16886.23-2023 |
医疗器械生物学评价 第23部分:刺激试验 |
|
|
GB/T 14233.2-2005 |
医用输液、输血、注射器具检验方法第2部分:生物学试验方法 |
|
|
化学表征 |
GB/T 16886.17-2005 |
医疗器械生物学评价 第17部分:可沥滤物允许限量的建立 |
|
GB/T 16886.18-2022 |
医疗器械生物学评价 第18部分:材料化学表征 |
|
|
包装运输 |
GB/T 4857系列 |
包装 运输包装件基本试验 |
|
清洗消毒灭菌 |
WS/T 367;WS 310.1;WS 310.2;WS 310.3 |
清洗消毒及灭菌技术操作规范 |
国外注册-检测方案
|
项目说明 |
标准编号 |
标准名称 |
|
安规 |
IEC 60601-1: 2005 + A1: 2012 + A2: 2020 |
医用电气设备 第1部分:基本安全和基本性能的通用要求 |
|
IEC 60601-1-6: 2010 + A1: 2013 + A2: 2020 |
医用电气设备 第1-6部分:基本安全和基本性能的通用要求 并列标准:可用性 |
|
|
IEC 60601-1-11:2015,AMD1:2020 |
医用电气设备 第1-11部分:基本安全和基本性能的通用要求 并列标准:在家庭护理环境中使用的医用电气设备和医用电气系统的要求 |
|
|
IEC 60601-1-12: 2014+ AMD1:2020 CSV |
医用电气设备 第 1-12 部分:基本安全和基本性能的通用要求 并列标准:预期在紧急医疗服务环境中使用的医用电气设备和医用电气系统的要求 |
|
|
报警 |
IEC 60601-1-8: 2006 + A1: 2012 + A2: 2020 |
医用电气设备 第1-8部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
|
EMC |
IEC 60601-1-2: 2014 + A1: 2020 |
医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验 |
|
专用标准 |
IEC 60601-2-4: 2010+ AMD 1:2018 |
医用电气设备 第 2-4 部分:心脏除颤器的基本安全和基本性能专用要求 |
|
生物学评价 |
ISO 10993-1:2018 |
医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
|
ISO 10993-5:2009 |
医疗器械生物学评价第5部分:体外细胞毒性试验 |
|
|
ISO 10993-10:2021 |
医疗器械生物学评价 第10部分:皮肤致敏试验 |
|
|
ISO 10993-12:2012 |
医疗器械生物学评价 第12部分:样品制备与参照材料 |
|
|
ISO 10993-23:2021 |
医疗器械生物学评价 第23部分:刺激试验 |
|
|
化学表征 |
ISO 10993-17:2023 |
医疗器械生物学评价 第17部分:可沥滤物允许限量的建立 |
|
ISO 10993-18:2020 |
医疗器械生物学评价 第18部分:材料化学表征 |
|
|
包装运输 |
ISTA系列;ASTM D4169系列 |
包装运输 |
|
清洗消毒灭菌 |
AAMI TIR12; AAMI ST98:2022 ;FDA Guidance |
清洗消毒及灭菌技术操作规范 |
|
ISO 17665-2024 |
卫生保健产品灭菌湿热医疗器械灭菌过程的开发、验证和常规控制要求 |
|
|
ISO 22441-2022 |
保健产品灭菌 低温汽化过氧化氢.医疗器械灭菌过程的开发、验证和常规控制要求 |
备注:上述标准包括了产品技术要求中经常涉及到的标准;企业需要根据产品的特点引用其他适用的标准
完整能正常工作的样机,其他具体详情请咨询CTI在线客服。
1、CTI具有专业资质、经验丰富的技术专家团队,为您提供专业咨询和服务。
2、CTI拥有先进的实验室设备,确保测试数据的准确和可靠。
3、CTI作为全球客户信赖的第三方测试认证机构,我们是您品质的背书。
4、我们凭借遍布全球的实验室网络,为您提供全面完善的一站式测试认证解决方案。
CTI的医疗器械检测的测试周期是多久?
实际周期根据委托的产品标准来确定,请与CTI客服联系确认。
CTI医疗器械检测的测试方法是什么?
针对产品的出口要以及客户委托的要求,进行标准检测。
CTI对于样品的留样周期是多久?
退样。