2024年1月17日,欧盟发布了一份关于MDR和IVDR对制造商现有语言要求的表格,表中概述了每个成员国的语言要求,其旨在帮助医疗器械和体外诊断医疗器械(尤其是中小型医疗器械)的制造商了解特定国家对医疗器械附带的信息和说明书的语言要求。
一、包含哪些信息要求?
---标签/IFU
---MDR:适用于患者/非专业用户和专业用户
---IVDR:器械的随附信息或自测/床旁检测
---植入卡
---自我符合性声明
---现场安全通知
---合格评定文件
---图形用户界面:适用于患者/非专业用户和专业用户
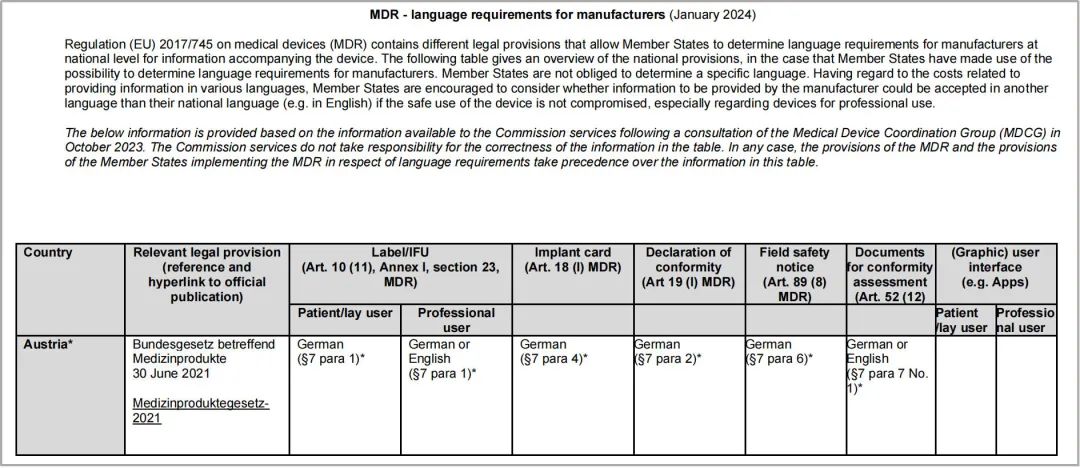
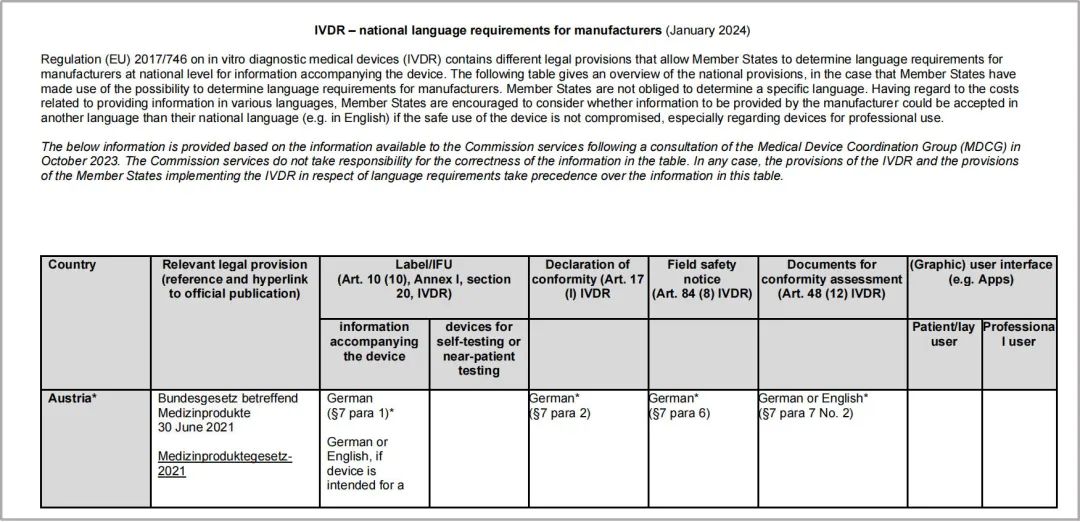
二、覆盖的国家有哪些?
欧盟委员会的语言要求表涵盖了31个国家:欧盟的27个成员国;冰岛、列支敦士登、挪威和土耳其。
但是不包括以下地区:北爱尔兰、瑞士。
在两份表格最后一栏都提到,其他语言的要求,详见如下:
---MDR其他语言要求:关于器械安全性和临床性能摘要(SSCP),Art.32 MDR,请参阅MDCG-2019-9 Rev.1指南文件,建议SSCP“以一种对预期用户和(如果相关的话)患者清楚的方式编写”【See MDR,Annex II(2),Article 10(11)】应将SSCP翻译成预期出售该装置的会员国所接受的语言”(第6页)
---IVDR其他语言要求:关于器械安全和性能概述(SSP),Art.29 IVDR,请参阅MDCG-2022-9模板。









































 粤公网安备 44030602000441号
粤公网安备 44030602000441号