“十四五”规划以来,国家卫健委多次出台相关政策法规,大力支持超声影像诊断设备等高端医疗设备发展,国家财政部、工信部在2021年5月明确要求包括超声影像诊断设备在内的137种设备全部采购国产。目前,国内各级医院及体检中心对超声设备的需求量日益增加,同时,国家医疗改革等行业政策利好、超声诊疗逐渐由超声科进入临床科室、产品型式持续不断的技术创新等多方面因素共同驱动,推动国内超声设备市场迅速发展并不断拓宽应用边界,持续开辟新的市场空间。据数据统计2017年到2021年,国内超声设备市场规模从3亿元增长到104亿元,年均复合增长率为2.8%。预计到2026年,国内超声设备市场规模将增长到171亿元,2021年到2026年年均复合增长率为10.5%。
产品结构和组成
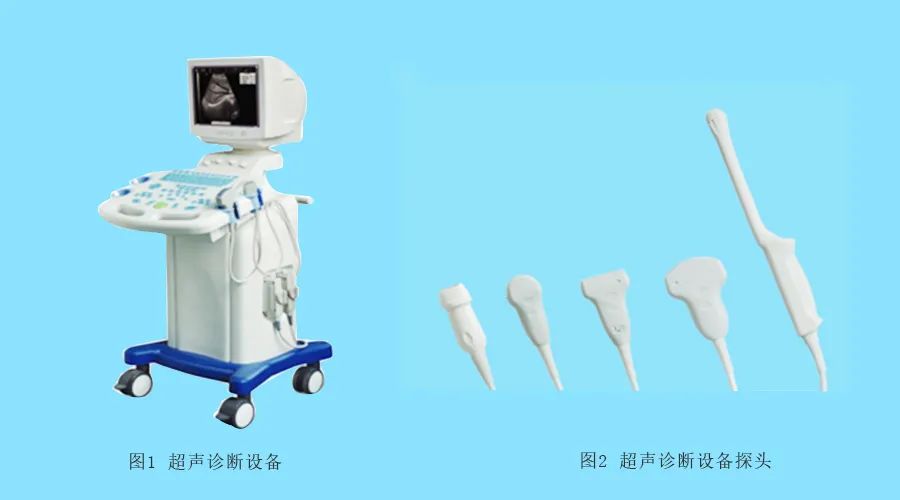
超声影像诊断设备主要由主机(含软件)、显示器、探头、选配件(如图像记录仪、图像存储器、彩色打印机、穿刺架等)组成;
探头主要由阵列换能器、传输线、连接器(可以含有控制器)等组成。
按照结构型式一般有:台车式、便携式和掌上式。
部分产品图如下:
产品分类等级
超声影像诊断设备在我国的医疗器械注册管理中,风险等级管理类别有II类和III类(根据注册探头)。
在医疗器械的分类目录上,超声影像诊断设备属于编码06“医用成像器械”,一级产品类别为07“超声影像诊断设备”。

注册单元划分
1、按工作原理不同可分为模拟设备和数字化设备(采用数字化波束成形技术的设备),模拟设备和数字化设备应按不同注册单元单独注册。
2、结构差异大、硬件平台/软件平台差异大的设备,应划分为不同的注册单元。
3、二维灰阶成像系统和彩色多普勒血流成像系统应划分为不同的注册单元。
4、超声成像系统中的移动式设备和携带式设备应划分为不同的注册单元。
技术要求关注点
产品技术要求应包括但不局限于以下内容:
1、产品性能研究;
2、应该对探头、穿刺架(若适用)等进行生物相容性评价生物相容性(如:细胞毒性、迟发型超敏反应、皮内反应或刺激);
3、清洗、消毒灭菌(如适用)验证,要明确消毒工艺及消毒方法;
4、产品货架有效期和包装研究(老化测试、包装验证);
5、软件研究;
6、声能安全研究等;
产品适用的标准
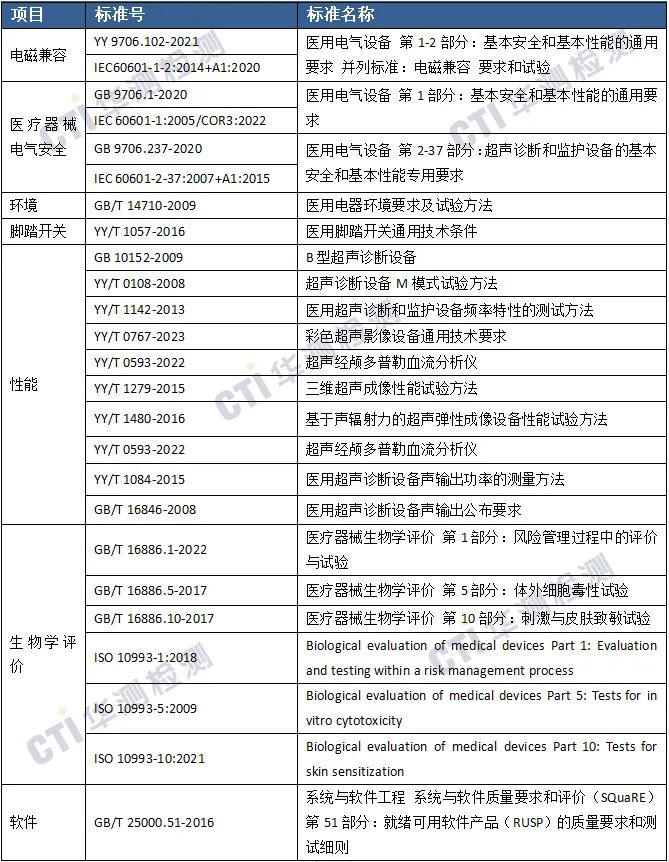
华测检测医疗器械实验室目前已经获得了以上大部分测试标准的CNAS、CMA授权,测试项目包括:医疗器械电气安全、EMC、软件测试、生物相容性测试、材料化学表征、理化及微生物测试、清洗消毒灭菌验证、包装运输及老化实验等,可以为医疗器械生产企业提供【超声影像诊断产品】全球市场准入的一站式注册检测服务方案。















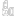
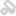











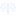
















 粤公网安备 44030602000441号
粤公网安备 44030602000441号