医械资讯周刊 | 2025年3月第三期,本期要闻:国家药监局发布关于进一步调整和优化进口医疗器械产品在中国境内企业生产有关事项的公告(2025年第30号),国家药监局综合司关于印发2025年医疗器械行业标准制修订计划项目的通知,关于征集参与《血管内超声诊断设备注册审查指导原则》等4项指导原则制定工作的相关企业及单位信息的通知...
1、国家药监局发布关于进一步调整和优化进口医疗器械产品在中国境内企业生产有关事项的公告(2025年第30号)
2020年9月,《国家药监局关于进口医疗器械产品在中国境内企业生产有关事项的公告》(2020年第104号,以下简称《公告》)发布实施。为深入贯彻党中央、国务院关于推进高水平对外开放等部署,全面落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)要求,持续深化医疗器械监管改革,促进医疗器械产业高质量发展,现就《公告》部分要求进一步调整和优化。并同步发布相关解读文件。
2、国家药监局综合司关于印发2025年医疗器械行业标准制修订计划项目的通知
国家药监局要求北京、天津、辽宁、上海、江苏、浙江、山东、湖北、广东省(市)药监局,中检院(器械标管中心)、器审中心,北京大学口腔医学院口腔医疗器械检测中心,机械工业仪器仪表综合技术经济研究所:
· 高度重视,认真组织本行政区域标准承担单位开展标准制修订工作,加强监督管理,确保按要求完成各项工作任务。
· 标管中心要认真组织协调各医疗器械标准化(分)技术委员会、工作组及技术归口单位,严格按照《医疗器械标准制修订工作管理规范》开展标准制修订工作,加强业务管理和指导,保证标准质量和水平。
· 承担标准制修订任务的医疗器械标准化(分)技术委员会、工作组及技术归口单位要做好标准的组织起草、验证、征求意见和技术审查等工作,要广泛调研、深入研究,确保标准技术内容的科学性、合理性、适用性以及与相关政策要求的符合性。
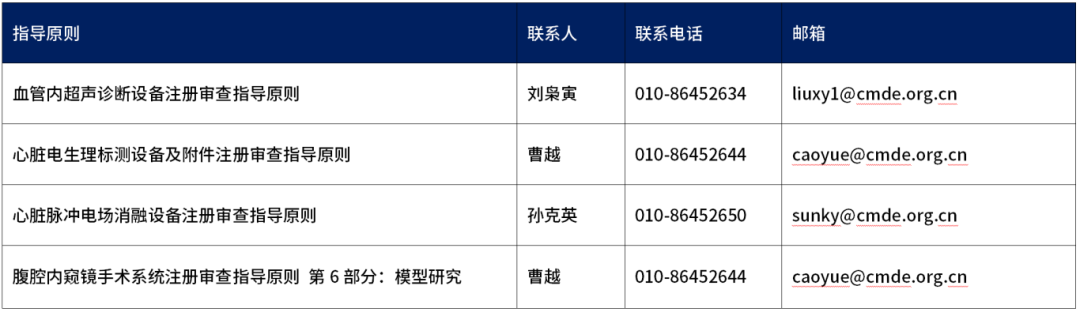
3、关于征集参与《血管内超声诊断设备注册审查指导原则》等4项指导原则制定工作的相关企业及单位信息的通知
按照2025年度指导原则编制计划,器审中心现已启动《血管内超声诊断设备注册审查指导原则》等4项指导原则的制定工作。现征集制定工作参与单位,邀请具有相关工作经验的境内外生产企业、科研机构、临床机构等积极参与。
4、国家药监局关于注销隐形眼镜多功能护理液等8个医疗器械注册证书的公告(2025年第28号)
按照《医疗器械监督管理条例》规定,根据企业申请,国家药品监督管理局现注销以下5家企业共8个产品的医疗器械注册证:
一、眼力健(杭州)制药有限公司的2个产品:隐形眼镜多功能护理液,注册证编号:国械注准20163160810;双氧水隐形眼镜消毒液,注册证编号:国械注准20143161869。
二、眼力健爱尔兰公司AMO Ireland的2个产品:隐形眼镜去蛋白片,注册证编号:国械注进20163162781;双氧水隐形眼镜消毒液中和片,注册证编号:国械注进20153163958。
三、施乐辉外科植入物(北京)有限公司的1个产品:非骨水泥髋臼系统,注册证编号:国械注准20203130288。
四、JPI Healthcare.Co.Ltd韩国丁元医疗有限公司的2个产品:乳腺摄影防散射滤线栅,注册证编号:国械注进20182060477;防散射滤线栅,注册证编号:国械注进20172067219。
五、南京溯远基因科技有限公司的1个产品:实时荧光定量PCR分析仪,注册证编号:国械注准20233221332。
5、国家药监局关于废止《医用中心吸引系统通用技术条件》等2项医疗器械行业标准的公告(2025年第31号)
广东省药品监督管理局发布2025年1月广东省内医疗器械生产许可证核发清单,总计23家企业获批生产医疗器械。










































 粤公网安备 44030602000441号
粤公网安备 44030602000441号