在全球食品贸易迈向更高标准化的时代,美国作为全球最大的食品市场之一,其食品安全监管体系备受关注。GRAS(Generally Recognized as Safe,公认安全)是美国食品成分合规的重要途径之一,对于希望进入美国市场的食品企业来说至关重要。
01.GRAS最新动态
近期,美国针对GRAS监管规则修订的提案引起了行业广泛讨论。
2025年7月及8月,美国议员陆续提出《2025年确保食品安全无毒法案》和《食品零售改革与安全法案》。两份提案内容相近,旨在终止自我声明GRAS途径,并要求所有通过自我声明的GRAS成分向FDA提交正式申请。但目前两份法案均处于初步阶段,尚无定论。企业需要密切关注法规动态,提前做好合规准备。
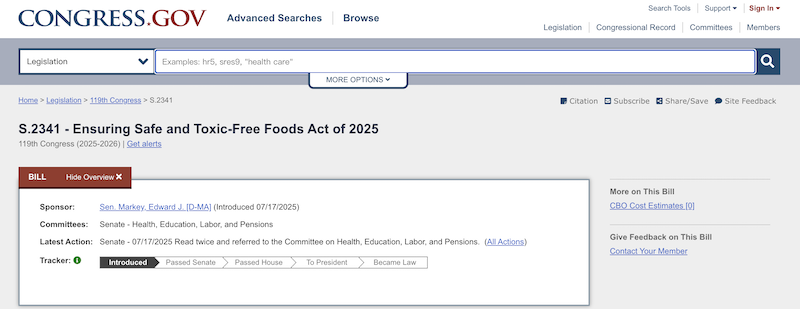
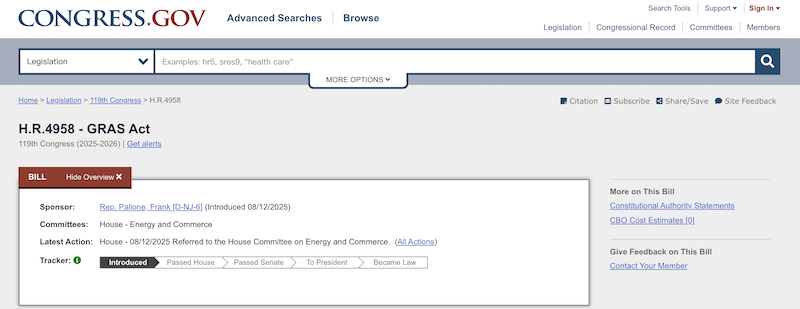
(图片来源:https://www.congress.gov/)
02.什么是GRAS?
GRAS全称为“Generally Recognized as Safe”(公认安全),是美国食品药品监督管理局(FDA)针对由合格专家普遍认为在预期使用条件下被充分证明安全的食品物质的一种分类。
根据《联邦食品、药品和化妆品法》,被评定为GRAS的物质可以豁免FDA的上市前审查和批准程序,即不需要进行食品添加剂请愿书(FAP)审批。

(图片来源:https://www.fda.gov/)
03.GRAS两种申报途径
目前,GRAS认定有两种方式:
1.自我声明GRAS(Self-GRAS):企业自行组织专家评审,内部存档,无需向FDA提交。这种方式周期较短,企业完成自我声明后即可在美国市场快速上市。
2.FDA通报GRAS(FDA-GRAS):向FDA提交材料,获得“FDA无异议函”后,信息会在FDA官网公开。这种方式通常在提交后还需要6-9个月的审核时间。
04.GRAS与其它合规途径的比较
美国对食品成分的监管以“安全性”为核心,目前主要有三大合规途径:
1.FAP(食品添加剂请愿书):最严格的合规途径,需要FDA正式审批,通常需1-3年时间。
2.GRAS(公认安全物质):灵活高效的合规途径,适用于已有充分安全性数据的原料。
3.NDI(新膳食成分):膳食补充剂的专属门槛,需至少在上市前75天向FDA提交通知。
值得注意的是,GRAS与NDI之间存在明显区别:GRAS认证后的成分可用于食品和膳食补充品,而NDI认证后的成分仅能用于膳食补充品;FDA-GRAS的安全性资料必须公开,而Self-GRAS和NDI可不对外公开。
05.GRAS认证的基本流程
无论是自我声明还是FDA通报,GRAS认证通常包括以下步骤:
1.可行性评估:分析现有产品、生产过程和相关研究资料;
2.差距分析:将现有数据与申报要求比较,确定是否需要补充更多安全数据;
3.数据补充:准备试验方案,进行产品质量安全相关测试和研究;
4.档案撰写:准备完整的档案,包括安全性数据和支持证据;
5.专家组评估:组织专家团队进行评审;
6.FDA提交:根据申报类别选择是否向FDA提交档案,获得“FDA无异议函”。
在全球食品贸易中,合规不仅是市场准入的要求,更关乎企业社会责任与全球消费者信任。GRAS作为科学合规路径,凸显了对食品安全与透明性的追求。CTI华测检测凭借深厚技术积累与全球法规洞察,致力于为企业提供GRAS合规与出海战略支持,助力企业精准高效合规,稳健开拓国际市场,让中国品牌赢得世界信赖。









































 粤公网安备 44030602000441号
粤公网安备 44030602000441号