医械资讯周刊 | 2025年5月第四期,本期要闻:经导管二尖瓣修复系统获批上市,国家药监局综合司关于贯彻实施《医疗器械网络销售质量管理规范》有关事项的通知...
1、经导管二尖瓣修复系统获批上市
近日,国家药品监督管理局批准了科凯(南通)生命科学有限公司经导管二尖瓣修复系统创新产品注册申请。
该产品由夹合器及输送系统、导管鞘组件组成。夹合器及输送系统由夹合器、植入导管和可操控套管组成。导管鞘组件由导管鞘和扩张器组成,导管鞘包括可调弯鞘和手柄。该产品采用经皮方式,适用于经心脏团队评估后认为存在外科手术高风险,且二尖瓣瓣膜解剖结构适合的退行性二尖瓣反流(MR≥3+)患者。
2、国家药监局综合司关于贯彻实施《医疗器械网络销售质量管理规范》有关事项的通知
国家药监局发文致各省、自治区、直辖市和新疆生产建设兵团药品监督管理局,为进一步加强医疗器械网络销售质量安全监管,规范医疗器械网络销售行为,保障公众用械安全,国家药监局发布了《医疗器械网络销售质量管理规范》(2025年第46号公告),自2025年10月1日正式施行《规范》。就有关事项进行通知,详情参考原文链接。
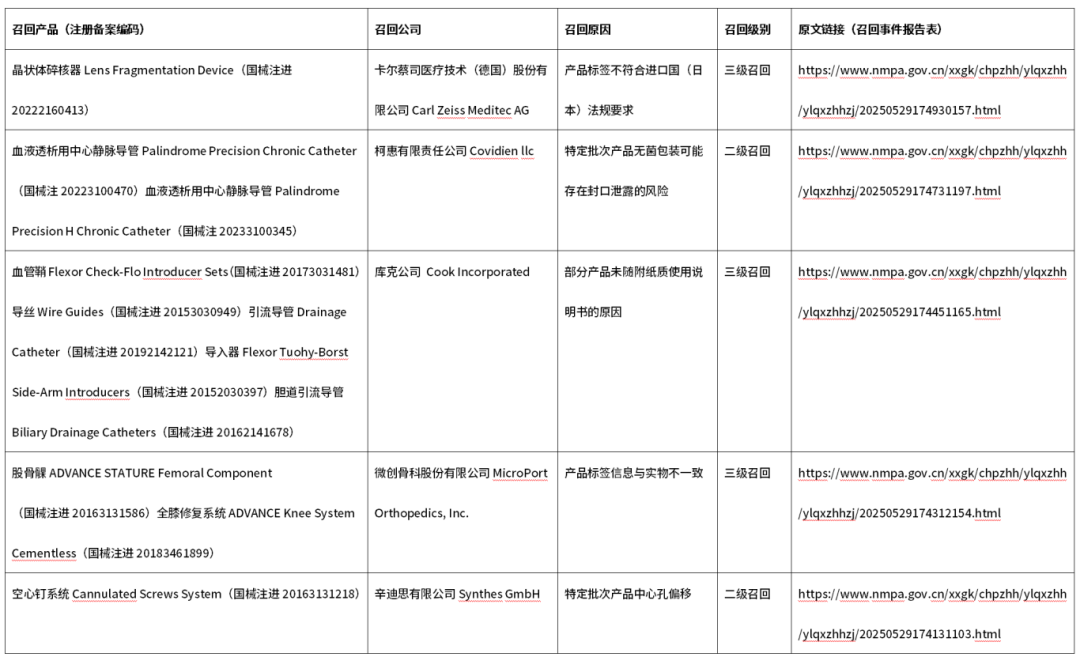
3、进口医疗器械召回信息
依据原国家食品药品监督管理总局《医疗器械优先审批程序》(总局公告2016年168号),对申请优先审批的医疗器械注册申请进行审核,现将符合优先审批情形的项目予以公示,公示时间为2025年5月21日至5月28日。
4、广东省药品监督管理局关于注销《医疗器械生产许可证》的通告(2025年第4期)
按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》有关规定,根据企业申请,广东省药品监督管理局依法注销广东合纵医药器械有限公司等8家企业的《医疗器械生产许可证》。详细内容请见原文链接。
5、广东省药品监督管理局关于同意新会江裕信息产业有限公司等11家注册人主动注销《医疗器械注册证》的通告
新会江裕信息产业有限公司等11家注册人向广东省药品监督管理局主动提出注销产品注册证的申请。根据《医疗器械监督管理条例》的规定,现对该11家注册人持有的27张《医疗器械注册证》依法予以注销(注销清单见原文链接附件)。
6、血液透析器产品是否可以通过变更注册增加不同膜面积型号
如增加的型号与原有产品相比,产品原材料、膜结构、主要性能指标及预期用途等相同,仅膜面积不同,可通过变更注册增加,但不同膜面积产品需按照膜面积选择典型性产品分别进行评价。
7、牙种植体产品结构设计注册技术审评关注点
中国器审发文,就牙种植体产品结构设计发展现状进行综述,并结合该类产品的技术审评情况,对牙种植体产品结构设计的技术审评关注点进行讨论,以期为相关产品的研发生产、注册申报及技术审评提供参考。详细内容请见原文链接。









































 粤公网安备 44030602000441号
粤公网安备 44030602000441号