医械资讯周刊 | 2025年6月第一期,本期要闻:广东省药监局关于2025年5月批准注册第二类医疗器械产品的清单,进口医疗器械召回信息...
1、广东省药监局关于2025年5月批准注册第二类医疗器械产品的清单
2025年5月,广东省药品监督管理局共批准注册第二类医疗器械产品322个,其中首次注册154个,延续注册168个(具体产品见附件)。
2、进口医疗器械召回信息
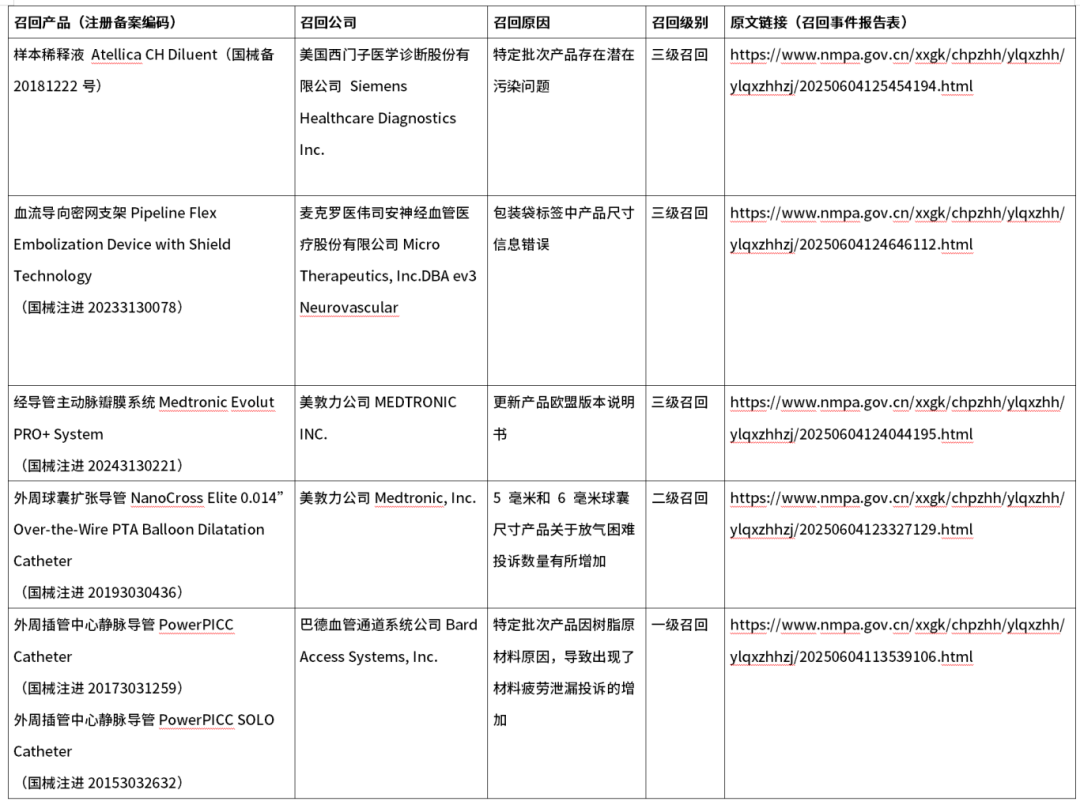
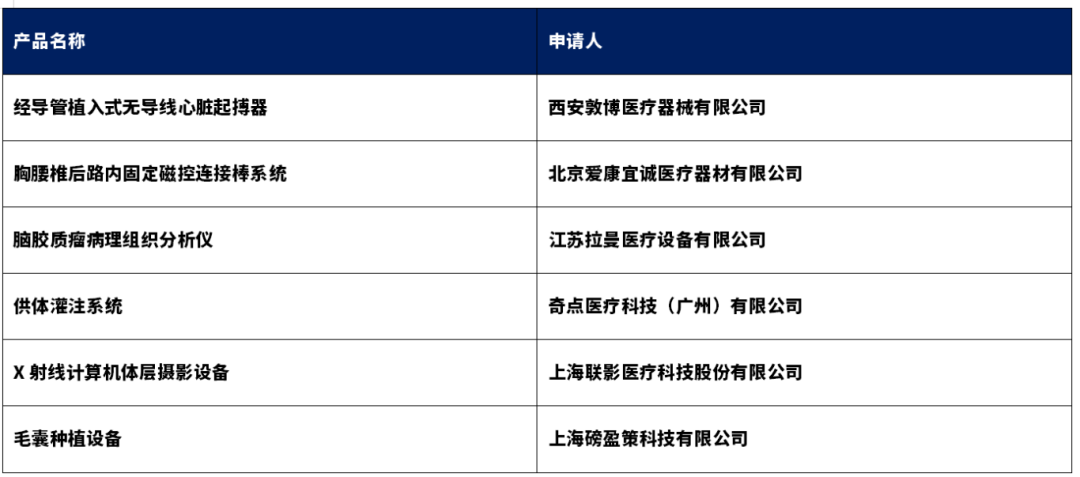
3、创新医疗器械特别审查申请审查结果公示(2025年第5号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现予以公示。公示时间为2025年6月3日至 6月17日。
4、2025年4月医疗器械生产许可证核发清单
广东省药监局发布2025年4月医疗器械生产许可证核发清单,总计涉及33家企业的医疗器械生产许可证核发。
5、进口整形美容用透明质酸钠类注射填充剂的上市证明文件中是否需要涵盖申报的适用范围
对于进口产品的适用范围,原则上应与境外上市证明文件载明的适用范围保持一致,不应擅自扩大范围。若上市证明文件中未涉及适用范围描述,申请人需提交文件以证明所申报适用范围产品在原产国合法上市和销售。
6、对用于肩锁关节脱位、下胫腓联合分离固定的带袢钛板产品,其疲劳性能研究中的载荷及循环次数应如何确定
对用于肩锁关节脱位、下胫腓联合分离固定的带袢钛板产品,其疲劳性能研究中的加载力需结合临床受力特征确定,应能模拟预期临床力学环境;其疲劳循环次数需结合临床使用情形、临床预期使用寿命和患者愈合周期确定,具体疲劳循环次数考虑因素如下:
(一)若为软组织修复期间提供骨与骨间固定的情形(带袢钛板不发挥骨折固定功能),疲劳循环次数可参照YY/T 1927-2024执行。申报资料中需说明申报产品“不适用于创伤类骨折固定和韧带永久替代”。若未说明,说明书中需要警示“不适用于创伤类骨折固定和韧带永久替代”。
(二)若适用于韧带撕脱小骨块固定情况,疲劳循环次数需结合临床使用情形、临床使用寿命和患者愈合周期确定,一般情况下循环次数可参考创伤类骨折修复周期的使用寿命要求。申报资料中需说明申报产品“不适用于韧带永久替代”。若未说明,说明书中需要警示“不适用于韧带永久替代”。
(三)除非有充分的生物力学和临床证据证明其安全有效性,否则不宜宣称带袢钛板能在下胫腓、肩锁关节处发挥韧带永久替代功能。










































 粤公网安备 44030602000441号
粤公网安备 44030602000441号