
一、产品的结构和组成
通常情况下每个完整的缝合器最基础的组成是缝合钉、器身和附件(拆除缝合钉的专用器具)。
器身一般有装钉装置、挤压装置、弹簧、外壳等;拆除缝合钉的专用器具一般应作为单独产品(I类)进行备案,也可作为附件一并申报注册,作为附件与缝合器整体注册时必须确定其相应的技术要求。

二、产品工作原理
缝合器工作原理与订书机相似,故其总称为Skin Stapler。缝合器通过挤压手柄,由机械传动装置将预先放置导针板上的缝合钉挤出、成形,达到预定的设计要求,有效对皮肤进行缝合;预装的缝合钉沿着导针板由恒力弹簧推进进行重复补充,以完成重复的缝合步骤,直至缝合钉用完。
三、风险管理类别
依据《医疗器械分类目录》,一次性使用皮肤缝合器的管理类别为II类;分类编码为02-13-01;
表2 《医疗器械分类目录》中的品名举例

四、注册单元划分的原则和实例
按照《医疗器械注册管理办法》第七十四条:医疗器械注册或者备案单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
与订书机相似、预期用途一致的皮肤缝合器可以作为一个注册单元;
五、产品检测方案
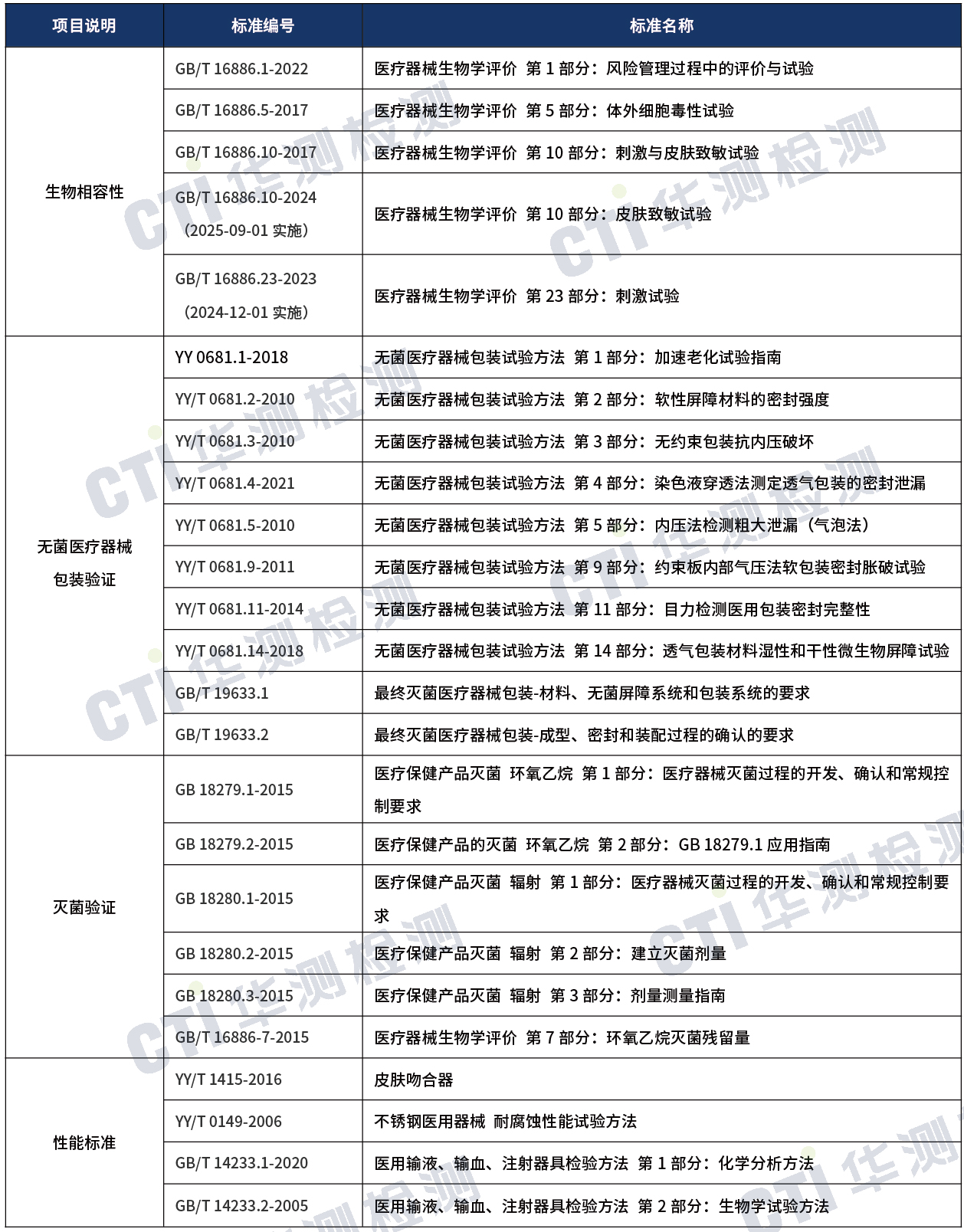
国内注册-检测方案
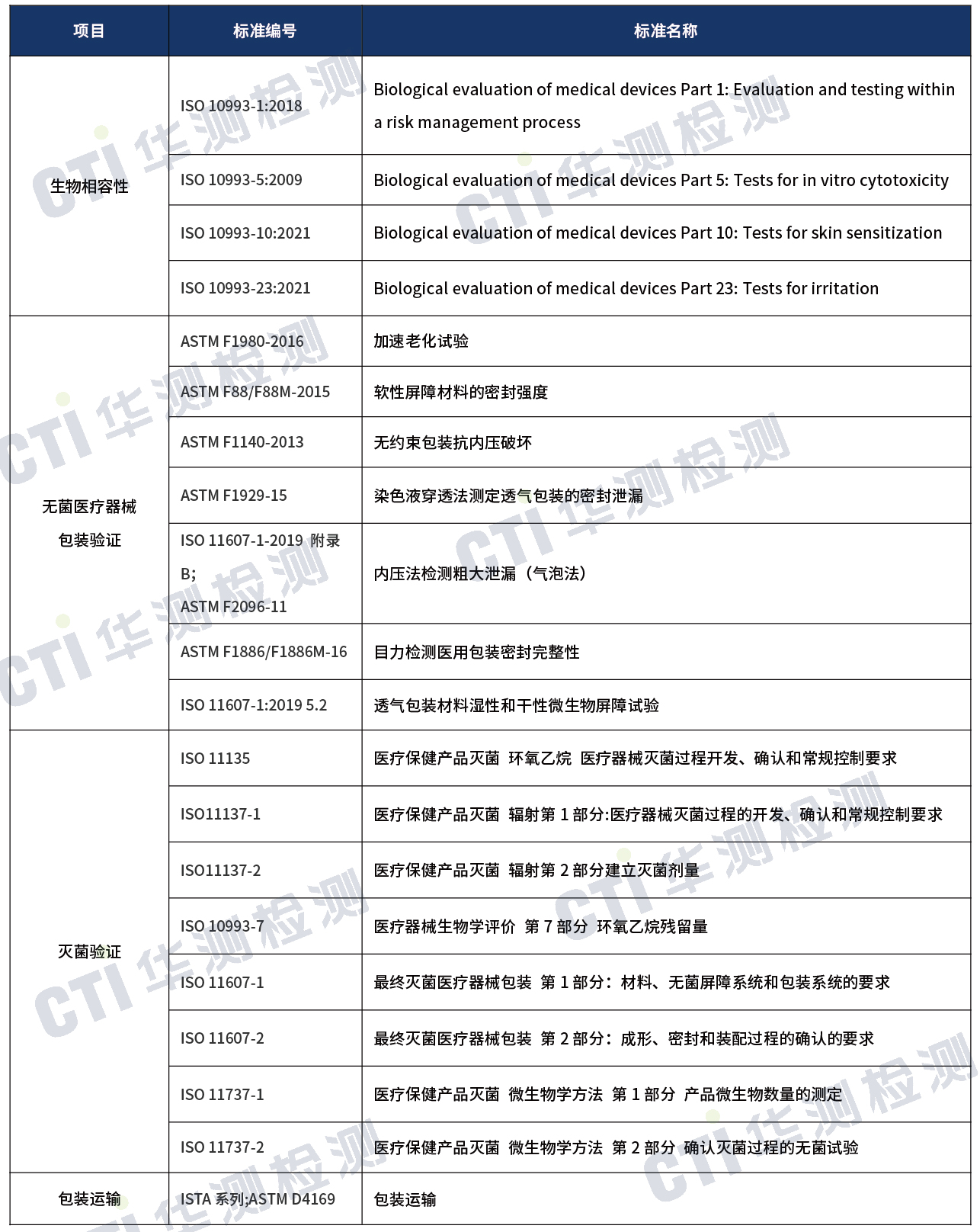
国外注册-检测方案
备注:
1)上述标准包括了产品技术要求中经常涉及到的标准,非全部标准,企业需要根据产品的特点引用适用的标准。
华测检测医疗器械实验室目前已经获得了以上大部分测试标准的CNAS、CMA授权,测试项目包括:生物相容性测试、灭菌验证、无菌医疗器械包装验证、包装运输等,可以为医疗器械生产企业提供【一次性使用皮肤缝合器】全球市场准入的一站式注册检测服务方案。










































 粤公网安备 44030602000441号
粤公网安备 44030602000441号