医械资讯周刊 | 2024年12月第四期,本期要闻:进口医疗器械召回信息,国家药监局关于泰科博曼(湖北)医疗技术有限公司飞行检查情况的通告(2024年第59号),广东省药品监督管理局关于注销《医疗器械生产许可证》的通告(2024年第11期),广东省药品监督管理局关于同意广州市暨华医疗器械有限公司等6家注册人主动注销《医疗器械注册证》的通告
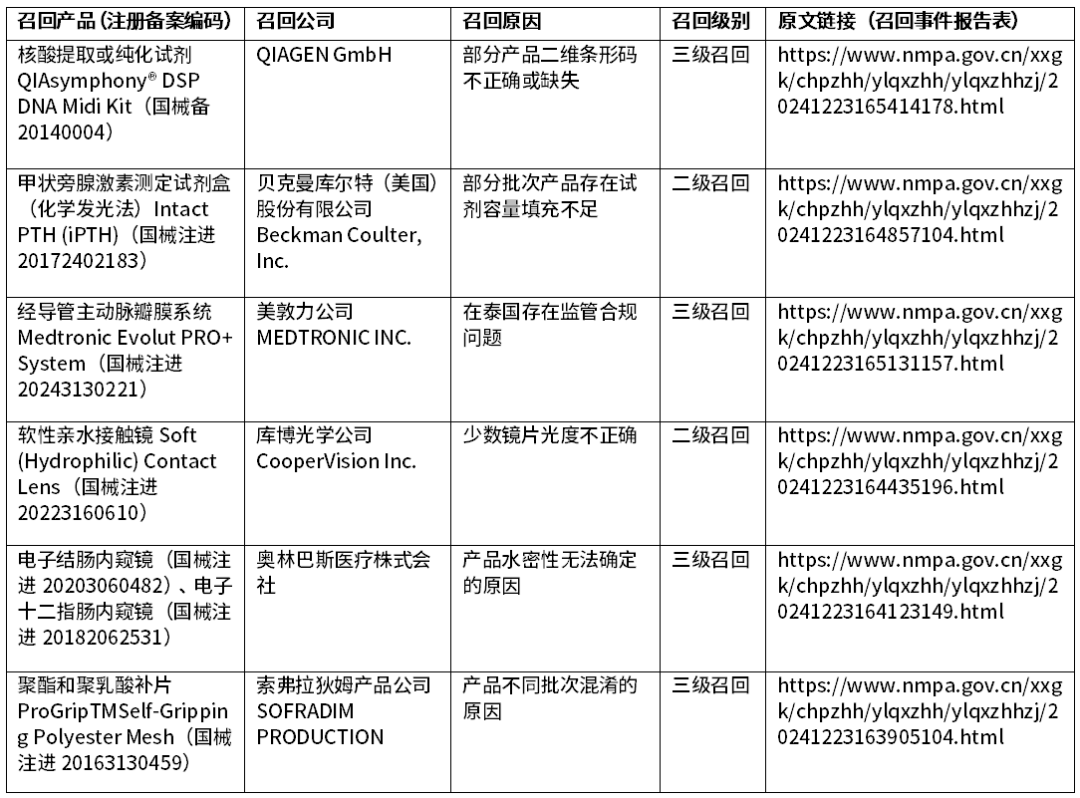
1、进口医疗器械召回信息
2、国家药监局关于泰科博曼(湖北)医疗技术有限公司飞行检查情况的通告(2024年第59号)
国家药品监督管理局组织检查组对泰科博曼(湖北)医疗技术有限公司进行飞行检查,发现企业的质量管理体系存在严重缺陷。
一、厂房与设施方面
企业关键加工区域的无菌灌装工序与间接支持区域的安瓿瓶清洗、灭菌工序处于同一功能间,不利于关键加工区域的隔离与运行,存在交叉污染风险,不符合《医疗器械生产质量管理规范》中厂房与设施应当根据所生产产品的特性、工艺流程及相应的洁净级别要求进行合理设计、布局和使用的要求。
二、生产管理方面
企业规定每年开展一次无菌加工过程生产工艺可靠性验证,但抽查企业2023年和2024年可靠性验证报告,发现未记录模拟灌装过程等关键内容,不符合《医疗器械生产质量管理规范附录无菌医疗器械》中灭菌过程应当按照相关标准要求在初次实施前进行确认,必要时再确认,并保持灭菌过程确认记录的要求。
企业质量管理体系存在严重缺陷,不符合《医疗器械生产质量管理规范》《医疗器械生产质量管理规范附录无菌医疗器械》等法规相关要求,企业已对上述存在问题予以确认。
属地省级药品监督管理部门应当按照《医疗器械监督管理条例》第七十二条规定,依法采取责令暂停生产的控制措施,必要时开展监督抽检;对涉嫌违反《医疗器械监督管理条例》及相关规定的,依法处理;责令企业评估产品安全风险,对有可能导致安全隐患的,按照《医疗器械召回管理办法》规定召回相关产品;企业完成全部缺陷项目整改后,经属地省级药品监督管理部门复查合格方可恢复生产。
3、广东省药品监督管理局关于注销《医疗器械生产许可证》的通告(2024年第11期)
按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》有关规定,根据企业申请,广东省药品监督管理局依法注销广东立德医疗科技有限公司等13家企业的《医疗器械生产许可证》。(详细企业信息见原文链接)
4、广东省药品监督管理局关于同意广州市暨华医疗器械有限公司等6家注册人主动注销《医疗器械注册证》的通告
广州市暨华医疗器械有限公司等6家注册人向广东省药品监督管理局主动提出注销产品注册证的申请。根据《医疗器械监督管理条例》的规定,现对上述6家注册人持有的10张《医疗器械注册证》依法予以注销(注销清单见附件)。










































 粤公网安备 44030602000441号
粤公网安备 44030602000441号